吉林省肝膽病醫(yī)院藥物臨床試驗(yàn)機(jī)構(gòu)辦事指南
辦事指南
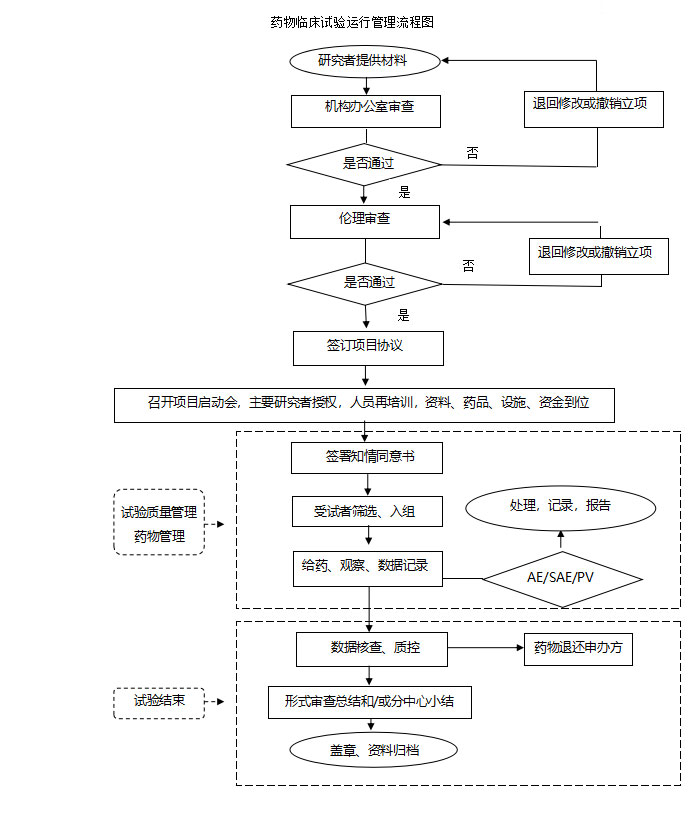
1.藥物臨床試驗(yàn)運(yùn)行管理流程
2.臨床試驗(yàn)項(xiàng)目受理與立項(xiàng)管理
●申辦方或?qū)I(yè)組負(fù)責(zé)人聯(lián)系機(jī)構(gòu)辦公室,機(jī)構(gòu)辦公室根據(jù)專業(yè)組臨床試驗(yàn)的現(xiàn)狀,與專業(yè)組負(fù)責(zé)人共同評估是否同意受理該項(xiàng)藥物臨床試驗(yàn)。
●臨床試驗(yàn)申請審查
1)專業(yè)組研究者到機(jī)構(gòu)辦公室領(lǐng)取或登錄醫(yī)院官網(wǎng)臨床試驗(yàn)機(jī)構(gòu)模塊下載并填寫《臨床試驗(yàn)申請表》,主要研究者簽名。
2)研究者根據(jù)“藥物臨床試驗(yàn)項(xiàng)目資料遞交清單”,與申辦方共同準(zhǔn)備資料并遞交機(jī)構(gòu)辦公室。機(jī)構(gòu)辦公室負(fù)責(zé)資料接收及形式審查:
3)辦公室形式審查通過后,通過后給予受理號,《臨床試驗(yàn)申請表》由機(jī)構(gòu)辦公室存檔;
●臨床試驗(yàn)項(xiàng)目通過臨床試驗(yàn)倫理委員會審核同意后,研究者將倫理審查批件遞交機(jī)構(gòu)存檔。機(jī)構(gòu)辦公室對臨床試驗(yàn)項(xiàng)目進(jìn)行立項(xiàng)。
●機(jī)構(gòu)辦公室負(fù)責(zé)臨床試驗(yàn)合同的簽訂管理工作,具體參照《臨床試驗(yàn)合同管理制度》;
3.臨床試驗(yàn)結(jié)題
●機(jī)構(gòu)確認(rèn)試驗(yàn)用藥品已退還申辦方并完成交接。
●申辦方完成項(xiàng)目稽查,并向機(jī)構(gòu)辦公室遞交稽查報告。
●機(jī)構(gòu)質(zhì)量管理員對文件資料進(jìn)行末次質(zhì)量檢查后,將紙質(zhì)CRF第一、三聯(lián)交申辦者用于統(tǒng)計(jì)分析(電子CRF:申辦方負(fù)責(zé)將電子數(shù)據(jù)刻盤后交于機(jī)構(gòu)存檔)。
●臨床試驗(yàn)結(jié)束并完成數(shù)據(jù)答疑后2個月內(nèi),研究者將項(xiàng)目全部資料按照機(jī)構(gòu)歸檔目錄要求整理完善后交機(jī)構(gòu)辦公室。
●項(xiàng)目結(jié)題的審查意見經(jīng)倫理委員會同意。
●機(jī)構(gòu)審核總結(jié)報告和(或)分中心小結(jié)表中的內(nèi)容與實(shí)際情況及統(tǒng)計(jì)報告中的內(nèi)容一致,審核內(nèi)容包括:研究單位名稱,研究者情況,受試者入組、完成情況,本中心實(shí)驗(yàn)室正常值范圍及不良事件記錄。